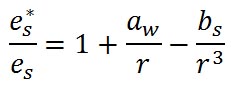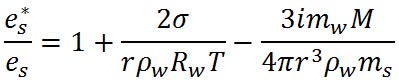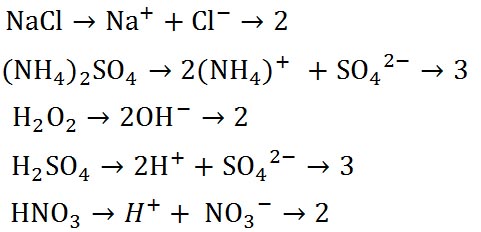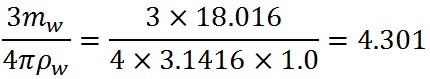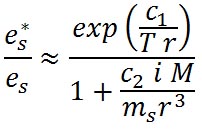微小水滴形成への溶質の影響 (1)
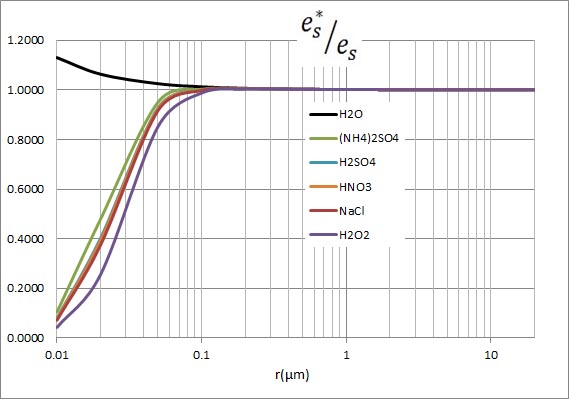
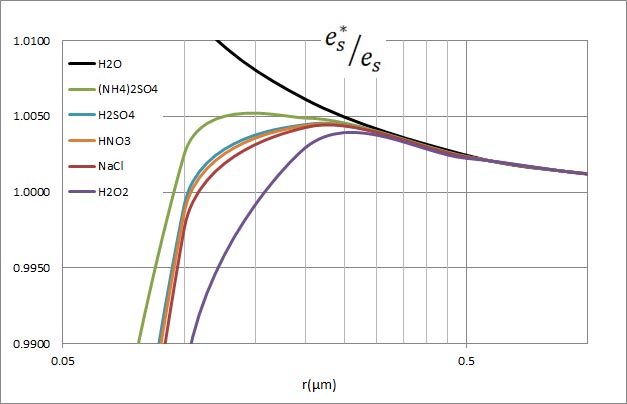
前回は、表面張力の作用により、半径の小さな水滴は過飽和状態にならないと形成されないことを説明した。水滴の半径が0.1 μmを下回ると、水滴が生じるための過飽和度が急激に上昇した。しかし、実際の大気中では1%以上の過飽和状態となることはめったにないとされている。したがって、純水のみが水滴となるという現象は生じていないと推定される。
水滴中に溶質が溶け込んでいると、その水滴から外部に水蒸気が飛び出す勢いが低下する性質がある。実際の水滴が生じる現象は、表面張力によって水滴が蒸発しやすくなる効果と、水滴中の溶質によって蒸発しにくくなる効果の、相反する効果の下で平衡が保たれている。
前回紹介した、飽和水蒸気圧と水滴の半径の関係の式に溶質の効果を加えたものは、ケーラーの式(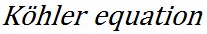 )として知られ、その一般的な形式は次のようなものである。 )として知られ、その一般的な形式は次のようなものである。
右辺の第2項は、水滴の半径に反比例しており、水滴の半径が減少すると相対湿度が上昇するという水の表面張力の効果を表している。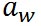 は係数である。 は係数である。
右辺の第3項は、水滴の半径の3乗に反比例しており、負号がついていることから、水滴の半径が減少すると相対湿度が減少し、水滴中に溶け込んでいる溶質の効果を表している。具体的な式を示すと以下の式がある。
ここで、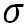 は水の表面張力、 は水の表面張力、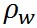 は水の密度、 は水の密度、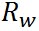 は水蒸気の気体定数である。また、 は水蒸気の気体定数である。また、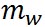 は水の分子量、 は水の分子量、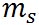 は溶質の分子量、 は溶質の分子量、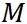 は溶質の質量である。 は溶質の質量である。
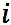 はファントホッフ係数(van't Hoff factor)と呼ばれるもので、溶液中の分子あたりのイオンの個数を示す。塩化ナトリウム(塩)、硫酸アンモニウム、過酸化水素、硫酸と硝酸についてファントホッフ係数の求め方を以下に示す。 はファントホッフ係数(van't Hoff factor)と呼ばれるもので、溶液中の分子あたりのイオンの個数を示す。塩化ナトリウム(塩)、硫酸アンモニウム、過酸化水素、硫酸と硝酸についてファントホッフ係数の求め方を以下に示す。
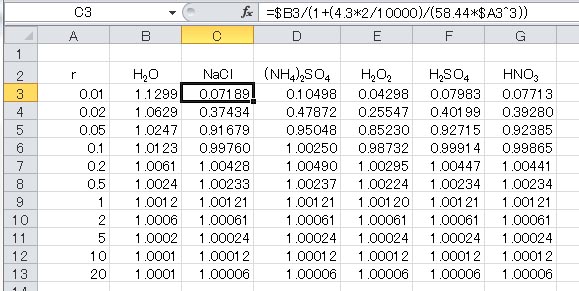
この式の右辺第3項中の定数をまとめると、以下のようになる。
上の式中、水の密度として1立方cmあたり1.0の値を用いているが、1立方μmあたりとすると10の12乗倍する必要がある。そこで、この定数を、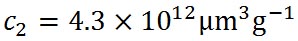 としたケーラーの式がシュトゥールの教科書に出ている。 としたケーラーの式がシュトゥールの教科書に出ている。
ここで、先にファントホッフ係数を計算した化合物における分子量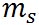 と と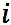 の値を下表に示した。 の値を下表に示した。
| 溶質 |
分子式 |
分子量(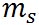 ) ) |
i |
塩化ナトリウム
|
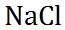
|
58.44
|
2
|
硫酸アンモニウム
|
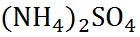
|
132.13
|
3
|
過酸化水素
|
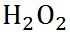
|
34.01
|
2
|
硫酸
|
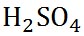
|
98.07
|
3
|
硝酸
|
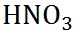
|
63.01
|
2
|
|